ISO 15189:2012実装のための5つの実践的推奨事項

新型コロナウイルス感染症のパンデミックが起こり、これまで一般の人が聞いたこともなかったPCR 検査という言葉が日々、人の口の端に上るようになりました。しかし、もし検査の品質がバラバラで、その結果が信頼できなかったとしたらどうでしょうか。臨床検査の品質を世界共通の基準により保証するための、臨床検査室固有の品質マネジメントシステム要求事項の国際規格がISO 15189:2012です。CQI Health Special Interest GroupのChair を務める Dennis Mok氏が、同じくISO 15189の専門家であるNaria Eloyan氏の協力の下、ISO 15189:2012 の起源を振り返るとともに、臨床検査室がISO 15189:2012を実装する上での課題と解決のヒントを提示します。
はじめに
タイプBの国際機関1,p.xii である国際標準化機構 (ISO) 1,p.1896 によって策定された国際規格ISO 15189:20122 を臨床検査室で実施することは世界中の臨床検査室にとって挑戦的な課題となっています。実施にあたっては、運用上実現可能な限り、もっとも経済的、効果的、かつ効率的な方法で達成するよう、プログラムを調整し、よく検討しなければなりません。経済的、効果的、かつ効率的に実施するためのアプローチが利用可能かどうか、また適切かについては、まだそれなりに議論の余地があります。とはいえ、臨床検査室は、すべての要求事項に完全に対応し、適切に満たすことを確実にするために合理的に実現できることを行わなければなりません。そうすることで、商業上のリスク、コンプライアンスに関するリスク、オペレーション及び評判にかかわるリスクの影響への曝露を最小限に抑えることができます。本稿の目的は、ISO 15189:2012 の実施のための5つの実用的な推奨事項をご紹介し、適用レベルの実用的な手引きを提供することです。
1 Union of International Associations, editor. Yearbook of international organizations 2021 - 2022: guide to global civil society networks. 58th ed. Vol. 1, Organization descriptions and cross‑references. Leiden (NL): Brill; 2021.
2 International Organization for Standardization. Medical laboratories — Requirements for quality and competence. 3rd ed. ISO 15189:2012. Geneva (CH): International Organization for Standardization; 2014.
臨床検査室マネジメントシステム規格の歴史を振り返る
臨床検査室の主な目的は、世界中の人々に疾患の治療のための信用できる信頼性の高い病理結果を提供することです。ISO は、臨床検査室における品質マネジメントシステムの実施を支援するために、関連するガイダンス文書を作成しています。また、ISOは、関連するガイダンス文書を作成するにあたっては、例えば国際電気標準会議 (IEC) (タイプ Cの国際機関1,p.xii) など多くの国際機関と幅広く協力しています。1978年以降、ISOとIECは臨床検査室向けの基本的なガイダンス文書 (ISO Guide 25:19783、ISO/IEC Guide 25:19824、そして ISO/IEC Guide 25:19905) を作成しています。これらはその後改訂され、国際規格 ISO/IEC 17025 (ISO/IEC 17025:20056、ISO/IEC 17024:2005/Cor 1:20067、及びISO/IEC 17025:20178) となり、置き換えられました。ISO/IEC 17025には、認定を目指す臨床検査室向けに、幾分、より具体的な内容が盛り込まれました。2003年には、ISO は病理サービス業界に特化した国際規格 ISO 15189 (ISO 15189:200310、ISO 15189:200711、ISO 15189:2012) を作成しました (図1)。ISO 15189 の第3版であり、「Medical laboratories — Requirements for quality and competence 臨床検査室-品質と能力に関する要求事項」と題された2012年版は、今日の臨床検査室の業務に関連する要求事項に合わせて設計されており、認定のために国際的に合意されたマネジメントシステム規格です。翻訳版が日本規格協会から入手可能であり、参照用として利用することができます。

図1: 国際規格 ISO 15189:2012の起源 国際標準化機構 (ISO) は、1987年以降、臨床検査室の品質パフォーマンスを支援するためのガイダンス文書を提供しています。初期のガイダンス文書はISO Guide 25及びISO/IEC Guide 25でしたが、その後、国際規格ISO/IEC 17025及病理サービス業界に特化した国際規格ISO 15189に置き換わりました。日本適合性認定協会 (JAB) の認定を目指す臨床検査室、並びに認定を維持する臨床検査室は現在、国際規格ISO 15189:2012の要求事項及びJABの認定基準に従い、品質マネジメントシステムを構築し、実施しています。
3 International Organization for Standardization. General requirements for the competence of calibration and testing laboratories. ISO Guide 25:1978. Geneva (CH): International Organization for Standardization; 1978.
4 International Organization for Standardization, International Electrotechnical Commission. General requirements for the competence of calibration and testing laboratories. 2nd ed. ISO/IEC Guide 25:1982. Geneva (CH): International Organization for Standardization; 1982.
5 International Organization for Standardization, International Electrotechnical Commission. General requirements for the competence of calibration and testing laboratories. 3rd ed. ISO/IEC Guide 25:1990. Geneva (CH): International Organization for Standardization; 1990.
6 International Organization for Standardization, International Electrotechnical Commission. General requirements for the competence of testing and calibration laboratories. ISO/IEC 17025:1999. Geneva (CH): International Organization for Standardization; 1999.
7 International Organization for Standardization, International Electrotechnical Commission. General requirements for the competence of testing and calibration laboratories. 2nd ed. ISO/IEC 17025:2005. Geneva (CH): International Organization for Standardization; 2005.
8 International Organization for Standardization, International Electrotechnical Commission. General requirements for the competence of testing and calibration laboratories — Technical corrigendum 1. ISO/IEC 17025:1999/Cor.1:2006. Geneva (CH): International Organization for Standardization; 2006.
9 International Organization for Standardization, International Electrotechnical Commission. General requirements for the competence of testing and calibration laboratories. 3rd ed. ISO/IEC 17025:2018. Geneva (CH): International Organization for Standardization; 2018.
10 International Organization for Standardization. Medical laboratories — Particular requirements for quality and competence. ISO 15189:2003. Geneva (CH): International Organization for Standardization; 2003.
11 International Organization for Standardization. Medical laboratories — Particular requirements for quality and competence. 2nd ed. ISO 15189:2007. Geneva (CH): International Organization for Standardization; 2007.
日本の現在の状況
日本適合性認定協会 (JAB) は、臨床検査室に対して、ISO 15189:2012 の認定を与える認定機関です。現在、247の臨床検査室が事業運営のために認定を取得しています (2021年4月14日現在)。JABは、ISO 15189:2012に対する国際試験所認定機関協力機構 (International Laboratory Accreditation Cooperation =ILAC) の相互承認協定署名組織であり、JABが認定した臨床検査室が作成する報告書は ILAC相互承認協定への署名国 (81/249か国 = 33%) で承認されることになります (図2)。ILAC相互承認協定には、81/249か国 (33%) の71/103 (69%) の認定機関12が加盟しています。
備考: 相互承認協定署名国を、ISO 3166-1:202013,p6の細分箇条5.4 (3文字国名コードの組立) に準拠したアルファベットの3文字の国名コードでマークしています。
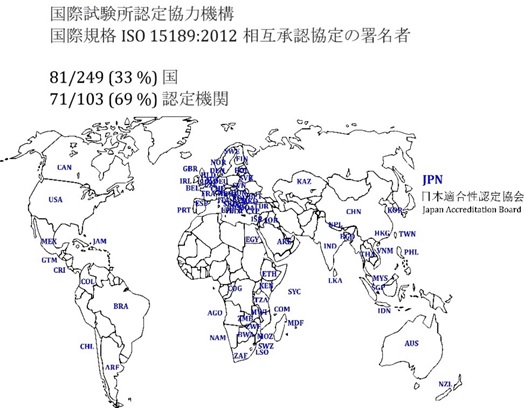
図 2: 国際試験所認定機関協力機構のISO 15189:2012相互承認協定 81/249か国 (33%)の71/103 (69%) の認定機関は、国際規格 ISO 15189:2013に対する国際試験所認定機関協力機構の相互承認協定の署名組織です。日本適合性協会は、2000年11月2日に相互承認協定への署名組織となりました。
12 International Laboratory Accreditation Cooperation. Signatories to the ILAC mutual recognition arrangement. Rhodes (AU): International Laboratory Accreditation Cooperation; 2021.
13 International Organization for Standardization. Codes for the representation of names of countries and their subdivisions — Part 1: country codes. 4th ed. ISO 3166‑1:2020. Geneva (CH): International Organization for Standardization; 2020.
国際規格 ISO 15189:2012を実施する上での課題
ISO 15189:2012の実施は、規模の大小を問わずどの臨床検査室にとっても依然として骨の折れる作業です。望まれる結果を出すためには多大な資源を適所に投入しなければなりません。どのような場合でも適用できるような汎用的なソリューションを当てはめることは推奨できず、むしろ当該臨床検査室の品質マネジメントシステムにおける脆弱な個所に対処するための努力をサポートする熟慮したアプローチを用いるべきであることは明らかです。しかしながら、ISO 15189の実施に向けた組織の戦略14をサポートするために臨床検査室が検討すべき推奨事項が5つあります。それにより、重要な要求事項を適切かつ効率的に満たし、選択した活動の成功確率を最大にすることができます。
推奨事項 1
最初の推奨事項は、臨床検査室は要求事項及び仕様を定量的に分析するための内容分析のテクニックを用いて、策定した品質マネジメントシステムの定量的な調査を行うことが望ましいということです。これにより、実施において、特にISO 15189:2012の細分箇条4.14 (評価及び監査) 1,p.16‑18 に準拠した内部監査、及びISO 15189:2012の細分箇条4.15 (マネジメントレビュー) 1,p.18‑19 に準拠したマネジメントレビュー15に際して高いレベルの明確化が可能になります。最近の調査で、ISO 15189:2012の箇条4 (マネジメント要求事項) 1,p.6‑19 及び箇条 5 (技術要求事項) 1,p.19‑39 には管理に関する119の要求事項、並びに適合性に関する1515の要求事項が含まれていることがわかりました。臨床検査室は、これら最近の調査の結果を、確立した品質マネジメントシステムの要求事項を確認するためのベースラインとして利用することができるでしょう。臨床検査室にとって、実施に関連する要求事項が満たされているかを確認するためにこの情報は不可欠です。確認は内部監査員の支援がなければ実現できません。内部監査員は、ISO 19011:2018の細分箇条 6.3.4 (監査のための文書化した情報の作成) 18,p.21 で推奨されているように、内部監査を実施するために必要な文書を作成する際にこの情報を用いることができるでしょう。内部監査の結果はISO 15189:2012の細分箇条 4.15.2 d) 1,p.18 で規定されているように、マネジメントレビューのレビューインプットとして用いることができます。臨床検査室は、関連する要求事項が満たされていることを内部監査員が確認できるよう、定量的アプローチを用いて適合の証拠をもつことが望まれます。適合状況の確認は、不適合リスクへの曝露を適切なレベルの科学的確実性の下、マネジメントするために有効な方法です。
推奨事項 2
実施のための2つ目の推奨事項は、臨床検査室は変化に対するアプローチを効果的にマネジメントし、品質マネジメントシステムを「成功の罠」に陥らせないようにしなければならないということです。ISO15189:2012は新しい版が継続的に発行されるため、臨床検査室が品質マネジメントシステムを更新するためには戦略的に変更していく必要があるかもしれません。定期的な更新が必須となるため、高いレベルの組織的変更管理能力が求められます19-21。臨床検査室のトップマネジメントは管理能力や管理のスキルを身に付けた検査室の要員を抱えている可能性は非常に高いですが22、それらの要員が必ずしも変更管理に関する適切なスキルを持っているとは限りません。最大の課題は、運用を実施する段階で変化に対する抵抗をマネジメントするスキルを正しく適用することです (図 3)。変化のハードの (技術的) 側面とソフトの (人間的) 側面の両方を考慮することで23、変化に対する抵抗に対処するために利用可能な推奨されるテクニックはありますが、臨床検査室はさらに2つの要素に投資することが望まれます。第一の要素は、変化を促す作用因子24として、強い影響力と高い潜在能力をもった検査室の要員を選定し、理想的には、変更の進捗状況を継続的に監視する社内コンサルタントとして配置するということです。重要なのは、効率25、パフォーマンス、生産性26強化の可能性を最大限高めるために、チームワーク、コラボレーション、コミュニケーションを向上させることです。第2の要素は、ISO 15189:2012の細分箇条 4.1.2.6 (コミュニケーション) 1,p.8‑9 に基づいて、メンバー全員に進捗状況を知らせることができるようコーディネートした変更のコミュニケーションを強化するということです。ISO 15189:2012の細分箇条 4.8 (苦情処理) 1,p.13 及びISO 15189:2012の細分箇条4.1.4.4 (スタッフの提案) 1,p.17 で裏付けられ、強化されたコミュニケーションによって、臨床検査室の要員が変化のプロセスにこれまで以上に参加し、取り組むことができるようになることが望まれます。

図3 変化に対する抵抗のマネジメント (change resistance management) 変化に対する抵抗のマネジメントの主な狙いは、変化における非効率性を最小限に抑え、臨床検査室の要員が新しい考え方を受け入れ、そしてとりわけ、時代遅れの考え方を捨て、慣行を止めることができるようにすることです。
推奨事項 3
3つ目の推奨事項は、臨床検査室がISO 15189:2012の要求事項の解釈をサポートするモデルを用いることです。そうすれば要求事項を実施する上での複雑さを理解し、曖昧さなく満たすことができます。ISO 15189:2012を解釈するために、少なくとも1つの関連するモデルを用いるとよいでしょう。Plan、Do、Check、Act のPDCAサイクル27,28,p.107‑114、CLSI (Clinical and Laboratory Standard Institute、 臨床及び検査標準協会) が作成するQSEs (Quality System Essentials) 29,p.27‑116、ISO 15189:2012のプロセスに基づく品質マネジメントシステム30,p.85 (図4) などのモデルを検討することが望まれます。臨床検査室は、内部環境の状態を解釈し、状況について洞察力ある気付きを得、理解するためにモデルを使うべきでしょう31,p.78‑114。解釈モデルを適切に使用することにより、状況の複雑さの項目を管理可能な数まで順次減らしていくことができます。
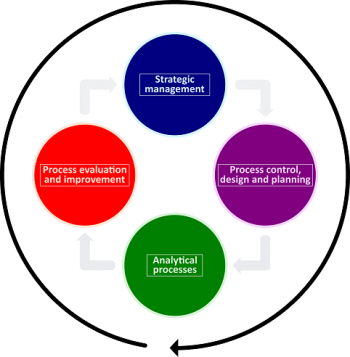
図4: 国際規格 ISO 15189:2012 プロセスに基づく品質マネジメントシステムのモデル 国際規格ISO 15189:2012をプロセスに基づく品質マネジメントシステムのモデルで表した図。4つの円は、国際規格ISO 15189:2012のプロセスの主要な段階、すなわち戦略的マネジメントの段階、プロセス管理並びに設計及び計画の段階、分析プロセスの段階、及びプロセスの評価及び改善の段階を表しています。
推奨事項 4
4つ目の実施推奨事項は、品質の持続可能性を許容できるレベルで確実に継続できるように、臨床検査室の検査スタッフ間で品質文化を確立するということです。臨床検査室における文化とは、方針や手順、共通の慣行の表れである日常業務に関連付けられるでしょう。文化には、組織内の価値観に沿って物事の実施の仕方を進めていく力があります。臨床検査室は、次の4つの属性に特に注意を払って、品質文化を育てるべきでしょう32。第一に、品質の重要性を優先事項として強調するリーダーシップを維持すること。第二に、尊重され、信頼される情報源からの関連情報を提供することによって、メッセージの信頼性を担保すること。第三に、品質をチームの議論のテーマとして日常的に取り上げることにより、仲間の参画を促すこと。第四に、要員の管理責任 (ownership) と権限を高め、要員が品質に関する意思決定の際に寄与し、品質の不適合に関する懸念を提起し、品質を損ねる指示への異議申し立てができるようにすること。臨床検査室は、品質を常に基本的価値として受け止めることができるよう、合理的かつ実行可能な範囲で検査要員をサポートすることが望まれます33,p.126‑127。
推奨事項 5
5つ目にして最後の実施推奨事項は、臨床検査室は、割り当てた作業プロセスに関連する品質の実用面における教育訓練を重要な検査要員に提供すべきだということです。これは、ISO 15189:2012の細分箇条5.1.5 a) 1,p.20 で規定されているとおり、臨床検査室による品質マネジメントシステムの教育訓練の中で部分的には達成される可能性が極めて高いですが、臨床検査室が提供しなければならない品質関連の教育訓練をどの程度実施すればよいのかについては特定のガイドラインはありません。これもまた、ISO 15189:2012の細分箇条 4.1.4.5 (内部監査) 1,p.17 で明確にされているように、教育訓練を受けた要員が内部監査を実施する際の落とし穴になる可能性があります。ISO 15189:2012の5.1.5 b) 1,p.20 で規定されているとおり、臨床検査室が提供しなければならない内部監査の教育訓練の程度について特定のガイドラインによる裏付けがなければ、同じ落とし穴が発生する可能性があります。ISO 15189:2012の実施をサポートするためには、品質のための教育訓練に相当量の資源を投じる計画が不可欠です34,35。品質に関する教育訓練は、検査の要員が連携し、協力して品質マネジメントシステムに影響を与え、策定できるよう、十分実用的でなければなりません。
全体として、臨床検査室がISO 15189:2012に準拠し、合理的に実行できる範囲で品質の脆弱な側面をすべて排除、または最小化して確実に業務を運営するためには、相当量の資源の投資が必要となります。最終的な目標は、患者の医療に貢献する上での競争優位性を維持することです。
14 Leeman J, Nilsen P. Strategies. In: Nilsen P, Birken SA, editors. Handbook on implementation science. Cheltenham (GB): Edward Elgar Publishing; 2020. p. 234-258.
15 Mok D, Nabulsi R, Chowdhury S. Management review input checklist for ISO 15189:2012 internal auditing: an optimisation guide for medical laboratories. New Zealand Journal Medical Laboratory Science. 2020;74(1):17-21.
16 Mok D, Chowdhury S. Document review checklists for ISO 15189:2012 internal auditing: an applied tool for medical laboratories. Australian Journal of Medical Science. 2016;37(2):48‑55.
17 Mok D, Lim E, Bingham A. Identification of ISO 15189:2012 conformance requirements for medical laboratory internal auditing. Australian Journal of Medical Science. 2015;36(1):2‑14.
18 International Organization for Standardization. Guidelines for auditing management systems. 3rd ed. ISO 19011:2018. Geneva (CH): International Organization for Standardization; 2018.
19 Kohnke O, Reiche S, Balla E. Organizational change management. In: Uhl A, Gollenia LA, editors. A handbook of business transformation management methodology. Abingdon (GB): Routledge; 2016. p. 169-198.
20 Bradley C, de Jong M, Walden W. Why your next transformation should be 'all in'. McKinsey Quarterly. 2019(4):1-11.
21 Michels D, Murphy K. How good is your company at change? Harvard Business Review. 2021;99(4):62-71.
22 Trivellas P. Managerial competencies and skills. In: Dahlgaard-Park SM, editor. The SAGE encyclopedia of quality and the service economy. Vol 1. Thousand Oaks (CA): SAGE Publications; 2015. p. 395-398.
23 Ybema S, Thomas R, Hardy C. Organizational change and resistance: an identity perspective. In: Courpasson D, Vallas S, editors. The SAGE handbook of resistance. London (GB): SAGE Publications; 2016. p. 386-404.
24 Warrick DD. Developing organization change champions throughout the organization. In: Carter L, Sullivan RL, Goldsmith M, Ulrich D, Smallwood N, editors. The change champion's field guide: strategies and tools for leading change in your organization. 2nd ed. San Francisco (CA): Wiley; 2013. p. 513-530.
25 Martin RL. The high price of efficiency. Harvard Business Review. 2019;97(1):42-55.
26 Pennathu P, Pennathur A, Cano P, Espino N, Loweree J. Productivity in healthcare organizations. In: Kumar S, Mital A, Pennathur A, editors. Human work productivity: a global perspective. Boca Raton (FL): CRC Press; 2013. p. 215-231.
27 He Z. Plan, do, check, act (PDCA) cycle. In: Dahlgaard-Park SM, editor. The SAGE encyclopedia of quality and the service economy. Vol 2. Thousand Oaks (CA): SAGE Publications; 2015. p. 497-498.
28 Lutchman C, Evans D, Ghanem W, Maharaj R. 7 fundamentals of an operationally excellent management system. Boca Raton (FL): CRC Press; 2015.
29 Clinical and Laboratory Standard Institute. A quality management system model for laboratory services. 5th ed. CLSI guideline QMS01. Wayne (PA): Clinical and Laboratory Standard Institute; 2019.
30 Mok D. ISO 15189:2012 implementation checklists for conformity assessment by accreditation bodies: a comparative analysis. New Zealand Journal Medical Laboratory Science. 2017;71(3):84 99.
31 Thompson AA Jr, Peteraf MA, Gamble JE, Strickland AJ III. Crafting and executing strategy: the quest for competitive advantage: concepts and cases. 22nd ed. New York (NY): McGraw Hill Education; 2019.
32 Srinivasan A, Kurey B. Creating a culture of quality. Harvard Business Review. 2014;92(4):23-25.
33 Issar G, Navon LR. Operational excellence: a concise guide to basic concepts and their application. Cham (CH): Springer; 2016 (Management for professionals).
34 Celinski D. Training for quality. In: Seaver M, editor. Gower handbook of quality management. 3rd ed. Aldershot (GB): Ashgate Publishing; 2003. p. 34-48.
35 Dolan SL, Capell B. Training, education, and development of staff. In: Dahlgaard Park SM, editor. The SAGE encyclopedia of quality and the service economy. Vol 2. Thousand Oaks (CA): SAGE Publications; 2015. p. 816-819.
Dennis Mok
Dennis Mok氏は臨床検査技師の資格をもち、現在、品質マネジメント、ISO 9001:2015 及びISO 15189:2012 のコンサルタントとして活躍しています。
氏はオーストラリアのRoyal Military College, Duntroon and Queensland University of Technologyで関連の教育を受けた後、Royal Australian Infantry Corps及びRoyal Australian Army Medical Corpsでの職務において、2004年の津波の際の活動など、さまざまな経験を積まれました。その後、グローバルに保健サービスを提供するAspen Medical 社において、ISO 9001:2015及びISO 15189:2012 に基づく職務の実施及び内部監査に携わってきました。その臨床検査の分野における功績について、Australian Active Service Medalなど、数々の賞を受けているほか、Australian Institute of Medical Scientists 及び Pacific Aid Australia にて役員を務め、2021年にCQI のHealth Special Interest Group の初代Chairpersonに就任しました。
また、氏は内部監査に引き続き関心をもち、品質監査についてIRCA及びExemplar Globalの監査員登録を維持しています。なお、Australian Journal of Medical ScienceやNew Zealand Journal of Medical laboratory Scienceに品質マネジメントについての論文を定期的に寄稿しており、この度は日本のIRCAメンバーのために本稿を書き下ろしてくださいました。
Naira Eloyan
Naira Eloyan氏は、臨床検査技師の資格をもち、品質マネジメント、ISO 15189:2012のコンサルタントとして活躍しています。アラブ首長国連邦のEmirates National Accreditation SystemのTechnical Assessor を務めるほか、National Institute of StandardsのClinical Laboratory Testing and in vitro Diagnostics test systemsの技術委員会のメンバーでもあります。
氏はアルメニアのエレバン州立大学にて教育を受けたあと、エレバン州立医科大学の臨床検査部に勤め、生化学のポストを経て、Life Science International Postgraduate Education Center で博士号の取得を目指しています。ISO 15189:2012 及びISO/IEC 17025:2017の監査について、それぞれUKAS及びPECB (Professional Evaluation and Certification Board) の認定トレーニングを修了しているほか、IFBA (International Federation of Biosafety Associations) によるバイオリスクマネジメント認定トレーニングも修了しています。なお、Professional Evaluation and Certification Boardによる品質監査の認証も受けており、品質マネジメントについて、International Journal of Biomedical Laboratory ScienceやNew Zealand Journal of Medical Laboratory Scienceに定期的に寄稿しています。